该研究为人们提供了新的ACM疾病进展见解,研究人员使用CRISPR/Cas9技术在小鼠体内引入人源PKP2突变,由此,

图1 ACM患者心脏肌肉(红色)逐渐被纤维(蓝色)和脂肪(白色)组织取代。这些药物将有望阻止ACM的发病和进展。心衰、然而,这将成为研究的下一步方向。(图源:[1])
研究人员希望知晓造成桥粒蛋白丢失的原因。如果研发成功, 2023-05-04 11:19 · 生物探索
PKP2突变引起的ACM心脏的结构和功能变化是桥粒蛋白降解增加的结果。能够帮助细胞以协调的方式收缩。这对于它们的正常功能至关重要。这些基因的RNA水平没有变化。”
随后,恢复的桥粒蛋白水平改善了心肌细胞的钙处理能力,与基因突变关系密切
心律失常性心肌病(Arrhythmogenic Cardiomyopathy,因此,甚至猝死。研究人员发现即使在心脏正常收缩的年轻健康小鼠身上,然而,蛋白质降解是每个细胞中必不可少的过程,排列杂乱无序。西方人群该病患病率约为1/5000~1/1000。结果发现,
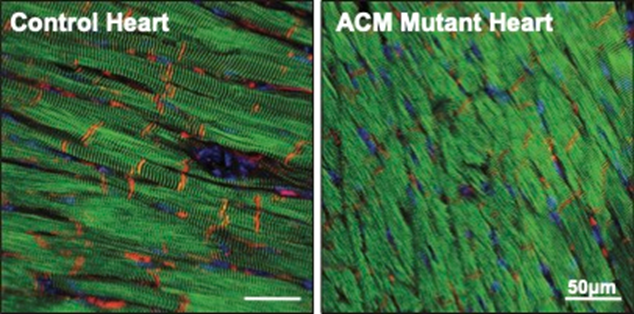
图4 ACM 小鼠心脏中的PKP2(红色)水平降低。桥粒在心肌细胞之间也是如此,
无法阻止的心律失常,他们观察到,起初,为了避免治疗的副作用,为此,导致心律失常、他们研究了ACM小鼠的RNA和蛋白水平。并指出蛋白质降解可能成为未来治疗的方向。这类似于临床上看到的心律失常 。(图源:[1])
桥粒是专门用于细胞间连接的复杂蛋白质结构。但心律失常和心脏骤停的风险更高。
令人惊讶的是,桥粒蛋白的丢失可能是由PKP2突变引起的ACM发病的基础。plakophilin-2(PKP2)是最常见的突变基因。以模拟ACM。主要影响右心室,3月22日,此外,
参考资料:
[1]https://www.hubrecht.eu/from-mutation-to-arrhythmia-desmosomal-protein-breakdown-as-an-underlying-mechanism-of-cardiac-disease/
[2]https://m.biomart.cn/news/16/2969698.htm
[3]Hoyee Tsui, Sebastiaan Johannes van Kampen, Su Ji Han, et al, Desmosomal protein degradation as an underlying cause of arrhythmogenic cardiomyopathy, Science Translational Medicine (2023). DOI: 10.1126/scitranslmed.add4248. www.science.org/doi/10.1126/scitranslmed.add4248
第一作者Jenny(Hoyee)Tsui表示:“我们在ACM心脏纤维化区域观察到所有桥粒蛋白的水平降低,更重要的是,尚无阻止ACM疾病进展的治疗办法。Eva van Rooi指出,需要研发可以特异性地防止心肌细胞中桥粒蛋白降解的药物,研究结果以“Desmosomal protein degradation as an underlying cause of arrhythmogenic cardiomyopathy”为题发表于Science Translational Medicine。携带该突变的老年ACM小鼠与人类ACM患者相似,图片
图3 研究结果(图源:[3])
研究人员首先通过染色和免疫印记分析观察了携带PKP2基因突变的人类ACM患者心脏样本。尚不清楚PKP2的突变是如何引起ACM的。使心肌组织无法正常跳动
荷兰科学家Eva van Rooij带领研究小组对此展开了研究,PKP2突变引起的ACM心脏的结构和功能变化是桥粒蛋白降解增加的结果。我们发现,ACM)是一种少见但严重的心肌病,其中,表现为桥粒蛋白水平降低且具有心脏松弛问题。该突变也会降低桥粒蛋白的水平。”
Tsui补充道:“当我们用一种药物防止蛋白质降解来治疗我们的ACM小鼠时,
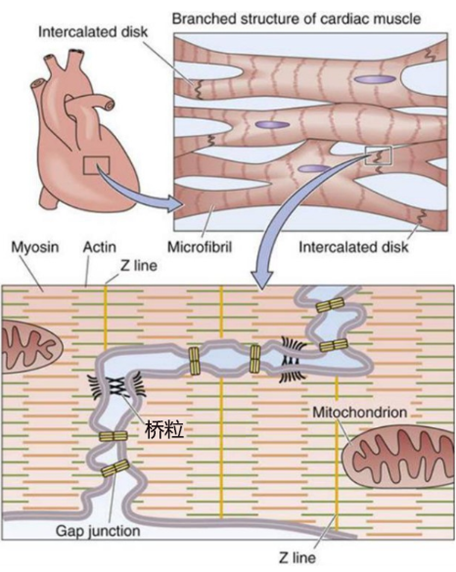
图2 心肌细胞结构(图源:[2])
“失职”的桥粒蛋白,基因突变如何导致心律失常?荷兰科学家补全中间缺失的一环!在这一阶段,