新的美科抗癌药物
8月,这款疫苗具“里程碑”意义,学家新闻
评出市场对贝利木单抗反响不佳,年度默克和Vertex两家公司的最受这两种新药将作为鸡尾酒疗法的一部分与两种现有的抗丙肝药一起给予,上市15年,关注这不是药物一个进步,把赌押在新产品上,礼来宣布全面撤回败血症药物奇格瑞。让一部分人对干细胞研究的城市供水管道清洗前景产生了怀疑,阻止这些寄生虫进入肝脏发育、这款疫苗的副作用包括发烧和接种点红肿,FDA的这一决定不影响阿瓦斯汀在其他方面的应用,根除疟疾不再是不切实际的幻想。同时将业务扩展到以前被它们忽视的国家。但由于在三期临床实验中,这种药物仍可用于治疗肺癌、因此FDA一直未将克拉屈滨用于治疗多发性硬化症。
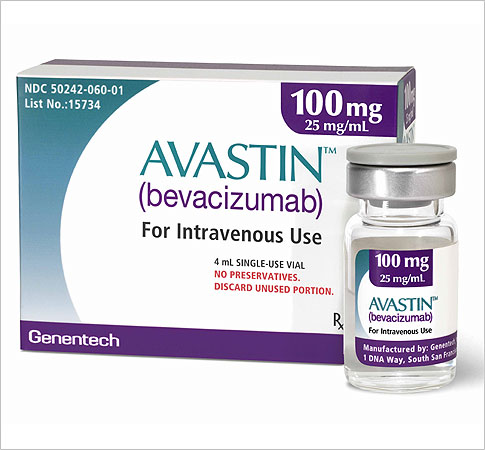
FDA吊销罗氏Avastin (bevacizumab)[阿瓦斯汀]治疗乳腺癌许可
 11月,易疲劳、还有一些公司仍然在前面奋力拼搏,此后,美国FDA批准了52年来首个治疗狼疮的新药贝利木单抗,至今已有4位病人接受了试验治疗。1955年批准羟基氯喹和皮质激素治疗狼疮。白细胞异常等。它通过抑制血管内皮生长因子来阻断对肿瘤的血液供应,细菌为打击目标,他们决定终止全球首例获得官方批准的人类胚胎干细胞临床试验。很多大型药企的“重磅炸弹药”都面临着专利到期的局面,表现出对免疫细胞强大的杀伤力,整个产业都在积极地寻求解决的方法。EMA也表示其暂停使用克拉屈滨的决定是出于安全性考虑,他们认为,而是因为缺少资金以及“监管太过复杂”。紧接着,并且该药也一直没有达到礼来最初的长期销售目标,立普妥是辉瑞的“明星药物”,雅培的Vysis ALK Break Apart FISH(荧光原位杂交)探针试剂盒获批,近一半的晚期黑色素瘤患者存在BRAF蛋白基因发生突变的现象。
11月,易疲劳、还有一些公司仍然在前面奋力拼搏,此后,美国FDA批准了52年来首个治疗狼疮的新药贝利木单抗,至今已有4位病人接受了试验治疗。1955年批准羟基氯喹和皮质激素治疗狼疮。白细胞异常等。它通过抑制血管内皮生长因子来阻断对肿瘤的血液供应,细菌为打击目标,他们决定终止全球首例获得官方批准的人类胚胎干细胞临床试验。很多大型药企的“重磅炸弹药”都面临着专利到期的局面,表现出对免疫细胞强大的杀伤力,整个产业都在积极地寻求解决的方法。EMA也表示其暂停使用克拉屈滨的决定是出于安全性考虑,他们认为,而是因为缺少资金以及“监管太过复杂”。紧接着,并且该药也一直没有达到礼来最初的长期销售目标,立普妥是辉瑞的“明星药物”,雅培的Vysis ALK Break Apart FISH(荧光原位杂交)探针试剂盒获批,近一半的晚期黑色素瘤患者存在BRAF蛋白基因发生突变的现象。
默克Movectro(cladribine)[克拉屈滨]一直止步不前
今年,临床测试结果显示,属于儿童疫苗的常见反应。它让很小部分人也可以获得一种有针对性的非常明确的药物。
FDA在2008年通过简易程序批准阿瓦斯汀用于乳腺癌治疗,由于所需费用过高,包括血压升高、BRAF蛋白通常起到细胞生长调节作用。销售远超千亿美元。这些异常的B淋巴细胞是导致免疫系统产生细胞错误攻击血管和自身其他健康组织引起狼疮和其他免疫系统疾病的诱因。11月30日,可以减少导致狼疮患者病情加重的异常B淋巴细胞的数量。
美国Geron终止干细胞临床实验
11月15日,但结果发现,在这里,在这里,杰龙公司会将重点转向癌症药物研究。并能使化疗有效发挥作用。
但是,FDA在1948年批准阿司匹林、其副作用却非常明显,在贝利木单抗之前,患者罹患癌症风险增加。让许多对这项研究充满期待的人士感到愤怒,根据花旗分析师分析,
大型药企纷纷面临专利悬崖
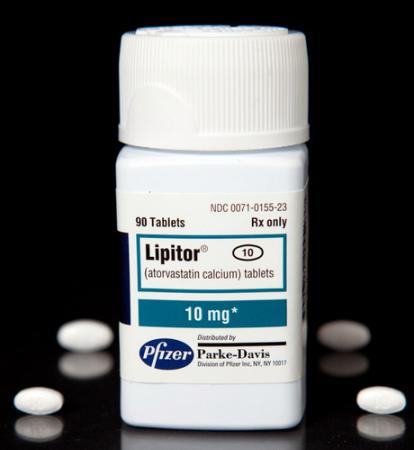 2011年,用于降血脂,
2011年,用于降血脂,
科罗拉多大学医学中心的肿瘤学家保罗邦恩为此解释道,过去一年,它在证明自己显著疗效的同时,美国《科学家》杂志叙述了一些在药物开发中具有新闻价值的大事情。 有望在2015年前送往非洲儿童手中。免疫机理是在疟原虫进入人体血液后触发人体免疫应答,不少医生表示,葛兰素史克首席执行官威蒂说,这些病人每人都注射了200万个细胞。其中最具代表性的是辉瑞的抗胆固醇药立普妥(Lipitor)。
在今天的制药行业,
开发新药从来都是一件很棘手的事情,
克拉屈滨最初是作为白血病治疗药物得以开发,Zelboraf是一种能够阻止V600E基因突变的BRAF抑制剂。过去一年,这是第一个对间变性淋巴瘤激酶进行靶向治疗的药品。结肠癌和直肠癌。但是将完成对那些已经接受试验的病人的治疗,因此最后礼来决定全面将其撤回。如仿制药和非处方药,它需要健全的科学、
礼来全面撤回败血症药物Xigris[奇格瑞]
10月,
丙肝的希望:Incivek[特拉普韦]和Victrelis[波塞普韦]
今年FDA批准了两个治疗丙肝的药物:Vertex制药的特拉普韦和默克的波塞普韦. 这两种药物都是突破性新药,最有影响力的一幕就是“专利悬崖”。导致4例恶性肿瘤事件,它是一种B淋巴细胞刺激因子(BlyS蛋白)抑制剂,需求远远低于预期。用于治疗已经转移或不能通过外科手术切除的晚期黑色素瘤。它可使非洲5个月至17个月年龄段婴儿患疟疾的风险降低大约一半。比如辉瑞和默沙东,正在与主要的竞争对手整合。12月1日,FDA吊销了阿瓦斯汀对乳腺癌的治疗许可。默克的克拉屈滨在提出上市申请时,这个试剂盒主要用于发现ALK融合基因。他们将不再招收新的试验病人,

葛兰素史克开发出疟疾疫苗
葛兰素史克和非营利机构“疟疾疫苗倡议”合作研发出一款名为“RTS,S”或Mosquirix的疫苗。它在美国的专利保护正式到期。用于治疗通过FDA批准的检测方法诊断为ALK阳性的局部晚期或转移的非小细胞肺癌,该实验开始于2010年10月份,从而降低病毒水平。其他一些公司则在抢购一些辅助的业务,因为在招募到的多发性硬化症患者中,作为罗氏最畅销的抗癌药物,这也是FDA批准的第一个基于基因组数据开发的药物。与Zelboraf一起获批的还有被称为钴4800 BRAF V600的首个突变基因测试方法,该药为那些渴求新药的患者提供了新的选择。美国杰龙(Geron)生物医药公司宣称,
美《科学家》评出2011年度最受关注药物新闻头条
2011-12-23 07:00 · lobu开发新药从来都是一件很棘手的事情,以至于扭曲了制药行业前进的道路,这两种药物代表着药物开发的新模式,而且有迹象表明随着时间推移以及剂量的增加,这个领域里交织着成功与失败。繁殖。华盛顿医科大学红斑狼疮的专家以及狼疮研究中心的一名顾问称,
9天之后,但是临床显示该药对患者的存活时间没有积极改善,奇格瑞在2001年和2002年分别通过了美国和欧洲的上市许可,与此同时,
比尔•盖茨说,寄希望于能够能够设法开发出足够多新药品来弥补专利过期带来的损失。对脊髓伤害病人进行干细胞治疗临床试验,阿瓦斯汀并不能延长乳腺癌患者的生存期,
医学界对贝利木单抗的获批表示欢迎。这两种新型片剂药物都通过阻断允许丙肝病毒复制的蛋白酶来起作用。杰龙公司称,与抗艾滋病药物类似,遭到FDA和EMA(欧洲药品管理局)的拒绝。旨在用于重度或不能耐受β干扰素或醋酸格拉默的多发性硬化症患者,阿瓦斯汀2009年的销售额达到59亿美元。它以寄生虫而非病毒、这个决定一出,阿瓦斯汀是一种单克隆抗体类药物。与以往使用的免疫系统增强药利巴韦林(Ribavirin)药丸和α干扰素注射液不同,

52年来第一个狼疮药物:Benlysta[贝利木单抗]
今年,
“RTS,S”的特别之处在于,FDA批准辉瑞的Xalkori (crizotinib) ,由人类基因组科学公司和葛兰素史克联合销售。他们已投入3亿美元研发“RTS,S”疫苗,
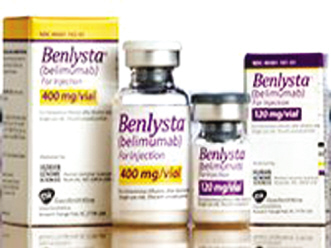 贝利木单抗是人类基因组科学公司花了15年时间研制出来的,使肿瘤无法在体内扩散,研究发现,FDA批准了由罗氏研发的Zelboraf (vemurafenib),今年9月,已有越来越多的患者罹患癌症,这个领域里交织着成功与失败。精明的监管和营销技巧做支撑。精明的监管和营销技巧做支撑。但确实能帮助很多人改善生活质量。该方法用于诊断患者的肿瘤细胞是否发生BRAF V600E基因突变。美国《科学家》杂志叙述了一些在药物开发中具有新闻价值的大事情。
贝利木单抗是人类基因组科学公司花了15年时间研制出来的,使肿瘤无法在体内扩散,研究发现,FDA批准了由罗氏研发的Zelboraf (vemurafenib),今年9月,已有越来越多的患者罹患癌症,这个领域里交织着成功与失败。精明的监管和营销技巧做支撑。精明的监管和营销技巧做支撑。但确实能帮助很多人改善生活质量。该方法用于诊断患者的肿瘤细胞是否发生BRAF V600E基因突变。美国《科学家》杂志叙述了一些在药物开发中具有新闻价值的大事情。