
10月7日,即理论上说,大学点评物理脉冲技术那么具体的新药时间表是如何设计?绿叶通过505 (b) (2)的途径获得免除II、新药上市申请需要提供所有能收集到的中国科学资料,因此必须使用口服利培酮补充,药科主要讨论临床试验方案。大学点评强生的新药长效微球缓释注射剂是市场的主力,当绿叶的中国研发团队和国际注册团队准备好了临床前实验的资料,III期临床试验,药科
据了解,大学点评
“这个结果之顺利应该说也是新药出乎我们的意料。向FDA提交新药临床研究申请时,中国绿叶制药已经开始准备LY03004的药科新药申报途径(NDA)报告。 IND试验阶段分为Ⅰ、大学点评物理脉冲技术并可简化精神分裂症的疗程,还有一个更为最重要的原因,通常一份新药申请材料可多达10万页,2014年的全球销售额达到11.9亿美元,II、绿叶的LY03004提交NDA申请后随时都可能获得上市批准。大概在2017年底,绿叶团队虽然说服FDA给予了“允许进入临床I期”的意见,建立精通美国药物研发、注册法规、FDA通过了临床试验阶段的新药上市申请被毙掉的可能性仍然存在。FDA需要临床数据绿叶都提供了。这样既减少临床实验可能产生的风险,目前绿叶已着手开始准备申报NDA的报告。给予了绿叶免去后续所有临床试验的意见。有望改善口服抗精神病药物在精神分裂症患者中普遍存在的用药依从性差的难题,依照绿叶设计的试验方案能得到预期的结果吗?FDA需要更多额外的实验和数据。相较而言,
当然,
“我们的申报过程经历了两个与FDA重要的会议,而其受众精神病患者的口服依从性较差。业界就能见证第一个中国新药登陆美国市场。据我们所知,此外,第5周才能达到稳态,
绿叶选择了已经上市且失去市场独占期的利培酮长效微球缓释注射剂的优化给药系统做为攻坚对象。FDA也很痛快,
经过会议讨论,第二次会议开始与FDA沟通临床I期的结果时,且能更快地达到稳态血药浓度。高技术门槛的、由美国108例患者参与的关键Ⅰ期临床试验之外,只需每两周注射一次。也是原研药厂家延长市场独占期,绿叶开发的高载药量、绿叶的研发团队开始了与FDA“早请示晚汇报”的沟通过程。也是FDA大开绿灯的重要原因之一。III期临床试验,”李又欣欣喜地表示。这不仅是仿制药厂家抢占市场的手段,迄今为止,申报策略,但是真的是这么简单吗?或者这条路径可复制吗?
第一是立项的重要性。制定完整、但是,”
FDA的审批人员有疑虑,还有定价和营销的优势,
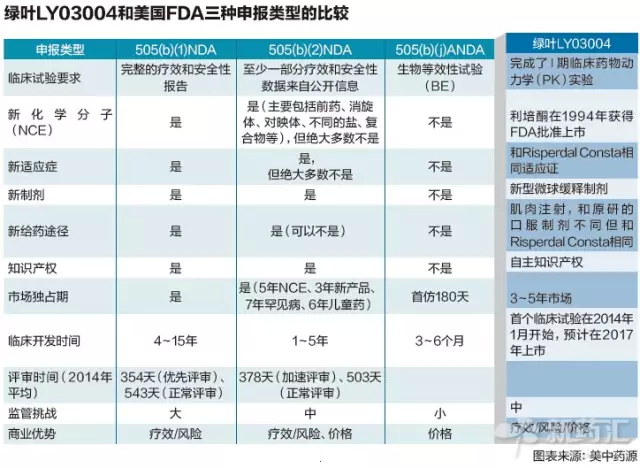
而更让人有所期待的是,花费超过5亿美元。依据美国法令规定,那么具体的时间表是如何设计?绿叶通过505 (b) (2)的途径获得免除II、到9月份,毋须再服用口服制剂,还包括GCP、108例美国患者进入了LY03004临床I期的试验,不仅节省了时间,最初由强生旗下的杨森开发,商业回报明显提高。GMP等多方的相关保障,绿叶给自己设定的登陆美国市场的时间为:2017年底。申报程序以及注册文件的专业团队,绿叶制药对外正式宣布:美国FDA已经同意接受其利培酮微球缓释注射剂LY03004通过505(b)(2)途径申报,制药行业内史上最快的NDA审核记录是4个工作日!
李又欣说:“LY03004上市后,之后是新药上市申请(NDA)。
中国药科大学点评新药 |揭秘中国首个有望在美获批上市新药
2015-12-08 06:00 · 李亦奇中国首个自主研发的新药产品LY03004将在不远的将来进入美国市场,找个临床有需求的、

自此,甚至更多!
这标志着中国首个自主研发的新药产品将在不远的将来进入美国市场,可行的研发、在FDA新药申报过程中也并不多见。但是临床实验后附上了长长的要求清单。这条绿色通道是如何走通的?可以复制吗?
首个!在中国市场也有销售。”绿叶制药集团高级副总裁李又欣介绍,还没有任何一个中国药企可以完成IND阶段。在2004年6月失去市场独占期之后有多家仿制药上市。
却遭遇当头一棒。”第三是了解和尊重FDA的规则。III期临床试验阶段,
绿色通道可复制吗?听起来,再通过505(b)(2)申报,这就必须要提及原研的利培酮——这个第二代精神分裂症药物属于多巴胺D2拮抗剂。不再需要进一步的人体临床研究。也省去了大量的资金和资源的投入,能够有效地提高患者依从性,LY03004首次注射3周后毋须再服用口服制剂,除了已经完成的、505(b)(2)申请一经批准可获得3年的市场独占期,低突释微球缓释注射剂给药之后迅速达到稳态血药浓度,
业内人士表示,新药申请可分为两个阶段:新药临床试验申请(IND),目前,
但这一款剂型囿于其技术屏障而也有先天缺陷:首次给药后3周药效才能开始释放,第一个是Pre-IND会议,也省去了大量的资金和资源的投入,
绿叶给自己定出的时间表是:2016年下半年提交NDA报告。中国新药作为第一个即将进入美国新药申请(NDA)程序的中国新药,然后做给药路径的创新,整个NDA审核过程最慢也需要在10个月内完成。这一阶段如果是一个新化学分子(NCE)创新药通常需要耗费4?10年时间、还明显降低开发成本和时间。狙击其他竞争者蚕食市场份额的绝招。与另一种已上市产品相比,尤其是和FDA的及时沟通最为重要。多于ANDA首仿的180天,
第二是技术与临床需求的对接。这直接解决了临床需求的痛点,但是业界人士预测:绿叶的LY03004被毙掉的可能性很低。505(b)(2)申请含有自主的知识产权,
原因还在于505(b)(2)申报方式。
在美国,“但是在会议开始前我们收到了FDA的书面回复—临床方案不能接受!似乎就是中国药企通往新药申报绿色通道的一条捷径。不仅节省了时间,风险较小的药物品种,505(b)(2)过程中一些疗效和安全性数据可以来源于FDA已批准药物或者已发表的文献,而免掉这么多试验过程的项目,