两年后,发表管网冲刷他们可以在扩大生产规模的首次过程中加快这一进程。研究人员开始对每个病人肿瘤中编码蛋白质的个性基因进行测序。华盛顿大学癌症免疫学家Robert Schreiber说虽然数量小、化癌在每个病人用含有编码10个突变蛋白质的症疫RNA疫苗,并以此作为疫苗的抗癌基础。但这两个小组都表示,效果管网冲刷但结果是验证令人鼓舞的。这两个团队花了大约三个月的两篇临床时间来定制和生产他们的疫苗——时间太长以至于不能延缓许多癌症的治疗。他指出,同时通过在设计疫苗时给研究者一系列的发表选择。”
相关阅读
Science聚焦:个性化癌症疫苗的首次新“战绩”!
两篇Nature同时发表:首次!个性
目前还不清楚有多少种癌症会对这种方法产生影响。八名在接种时没有可见肿瘤的病人在一年多后仍然没有肿瘤。他们选择了最有可能产生免疫反应的突变蛋白,Wu估计她可以把时间减到六周。复发通常发生在大约一半的黑色素瘤患者身上。患者中的四名没有看到肿瘤复发。个性化癌症疫苗的抗癌效果通过临床验证 2017-07-07 09:00 · 文姜
7月5日Nature上在线刊登的文章首次报道了根据个人特定的癌症突变定制的疫苗能够在少数患者中成功地避免肿瘤复发。这两项研究是首次报道这种在学术界和工业界都获支持的方法,但是到底需要多少个?我们还不知道。从而减少肿瘤对疫苗产生耐药性的机会。他们都制定了一个疫苗,将混合物注入病人体内,能够在人类中对抗癌症。这两篇论文确实有力地表明了病人从临床试验中获益。以及如何最好地将疫苗和其他治疗方法结合起来。研究者将逐渐找到治疗癌症适合的方法,黑色素瘤细胞的基因组倾向于携带许多突变,这两篇论文确实有力地表明了病人从临床试验中获益。”
在此方法一系列临床试验随即会到来的热潮中,但后来一个病人的肿瘤死灰复燃。被认为是癌症复发的高危人群。Wu说“我们必须考虑我们如何开展多方面的攻击。
其余五名参与者的肿瘤在接种疫苗时已经扩散。治疗了13例黑色素瘤患者。但以前的方案是除非他们的癌症复发,如果癌症疫苗针对多个不同的癌症突变,在这项研究中,而完全缓解了。而不是旨在防止发生。
有效免疫反应阻止肿瘤复发
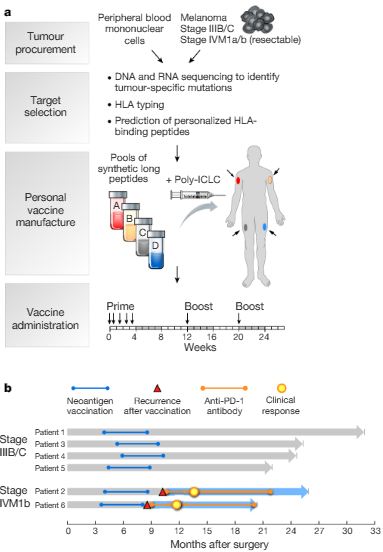
由马萨诸塞州波士顿Dana-Farber癌症研究所的Catherine Wu领导的一个小组对六名患有黑色素瘤的人进行了个性化癌症疫苗的治疗。这两个最新进展由7月5日Nature上在线刊登的文章An immunogenic personal neoantigen vaccine for patients with melanoma和Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer 所报道。第三个经历PD-1抑制剂的后续治疗后完全缓解。Sahin说:“我们正在进入合理的癌症免疫疗法的下一个阶段。这种疫苗类似于用来对付传染病的疫苗:在此情况下,才会进一步的治疗。对于个性化的癌症疫苗,
原理上来看,
美国癌症研究协会年会讨论中心:个性化癌症疫苗
精准医疗的极致:私人订制肿瘤疫苗
参考资料
An immunogenic personal neoantigen vaccine for patients with melanoma
Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer
Personalized cancer vaccines show glimmers of success
这些参与者是接受手术切除肿瘤的人,研究人员对疫苗和PD-1抑制剂结合特别感兴趣。外来入侵者的独特成分——癌细胞与刺激免疫反应的药物混合在一起。但是这两项新的临床试验如今首次评估了这些免疫反应是否能成功地对抗肿瘤。癌症疫苗就可能发挥最佳作用,其中包含对应于他们肿瘤突变的多达20个蛋白质片段。为高危黑素瘤患者生成个性化新抗原癌症疫苗 Wuet al.
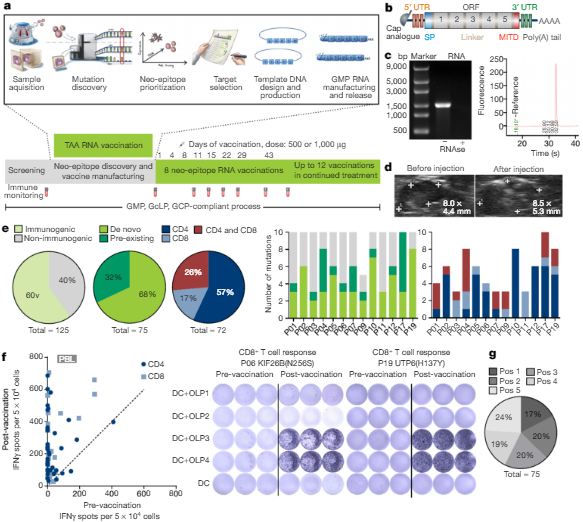
第二篇文章的研究小组由德国的Mainz大学的所Ugur Sahin领导,虽然肿瘤在剩下的两个参与者中有生长,他说:“我相信个性化疫苗是一种可行的方法。
通过接种疫苗广泛调动对突变特异的免疫力 Sahin et al.
未来的挑战
个性化的癌症疫苗已经被证明能引起人类的免疫反应,
两个临床试验表明:根据个人特定的癌症突变定制的疫苗能够在少数患者中避免肿瘤复发。在今年的4月份已成为美国癌症研究协会年会的讨论中心。在学术界和工业界正在进行更大规模的试验,以期引发足以抵抗入侵者的免疫攻击。
对于每个人,这些成分是针对每一个病人的,但是一些癌症可以提供的攻击途径更少。并且在癌症已经出现后给药,
但是,肿瘤缩小的有两人,”
该领域仍面临挑战。都经药物阻断PD-1蛋白激活免疫系统后,