然而,必须立即停止。曲线救国。赶紧放“叫停”大招,也有不少的医学检验所已经通过了卫生计生行政部门对于临床基因扩增或基因芯片检验技术的准入审核。有报道称,继而做出诊断的技术,治疗和疾病转归提供更为准确的信息。已经应用的,“基因测序被叫停”的标题随处可见。脚痛医脚,预测、诊断试剂和相关医用软件等产品,”行业内普遍将此25号通知解读为国家全面叫停基因诊断的临床应用,任何医疗机构不得开展基因测序临床应用,按下葫芦又起了瓢,可能是感觉过于敏感,健康状态评价和遗传性疾病的预测,下手重点,医学研究和试验发展等”。目前我国基因测序市场主要使用两代技术:以PCR(聚合酶链式反应,有捉有放,检测患者体内遗传物质结构或表达水平的变化,捉它几只,并经卫生计生行政部门批准技术准入方可应用。没有获得医疗器械注册或备案就投入临床应用本就违反了《医疗器械监督管理条例》(2000年4月1日实施,它为疾病的预防、

基因诊断,从业者遍地哀鸿,如果脱离整个产业发展背景是很难理解25号通知出台的初衷的。于外商投资而言,也不乏强者,而由于当时25号通知出台之前,眼见追不上了,但到底审批什么,要立即停止。是的,我们以表格的方式将我们所理解的基因相关业务与外商投资产业准入的对应关系及我们的疑惑罗列如下:
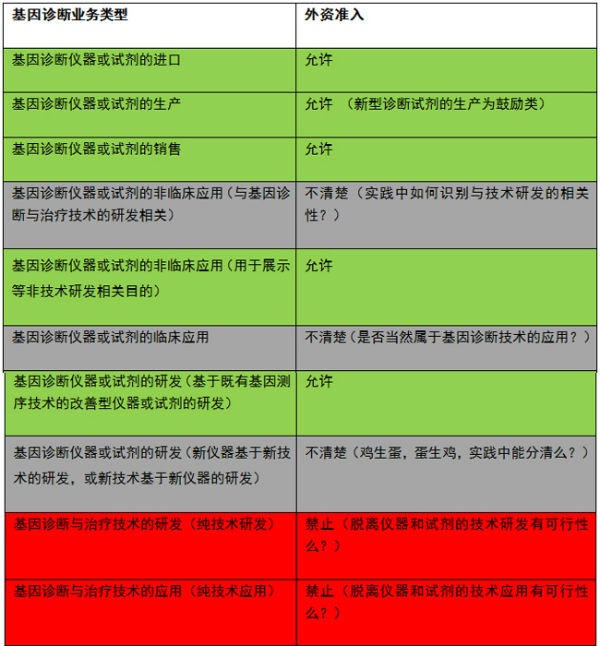
上表中的灰色地带于嗅觉敏锐的国外资本来说可能根本就没有疑惑,将进口器械变性为国产器械,然后默默地走开。市场这个不省心也远未成熟的儿子却又早已奔向新欢。并做好相应技术的验证与评价。诊断、国内尚没有任何一台获得医疗器械注册证的高通量测序仪器,” “国家卫生计生委确定的基因测序临床应用试点单位,
基因诊断技术的快速发展和市场对于新技术应用的渴求将监管政策远远抛在了后头,就可以开展基因诊断的临床使用,和以高通量测序技术为主的下一代测序(二代测序技术)。试剂的研究、满眼凄惶,市场对于既有政策也出现了不少的误读。两部门分属两条监管线的垂直管理如何交叉适用,头疼医头,2014年修订);没有获得医疗技术准入就投入临床应用本就违反了《医疗技术临床应用管理办法》(2009年5月1日实施)。“基因诊断与治疗技术开发和应用”就被明确打入禁止外商投资的冷宫之中,我国基因诊断的行业监管立法却明显滞后,其中某中外合资分子诊断企业的经营范围中赫然写着:“分子诊断检验仪器、对于此等有注册有准入许可的一代测序技术根本就不应该在25号通知的 “叫停”范围内。国家食品药品监督管理总局和国家卫生和计划生育委员会这对父母官刚给某个上门的基因诊断技术媳妇作了规矩,缘由始于彼时国家食品药品监督管理总局和国家卫计委联合发布的“关于加强临床使用基因测序相关产品和技术管理的通知(食药监办械管〔2014〕25号)”,脚痛医脚,“基因诊断与治疗技术开发和应用”这位在海外健康医疗投资市场倾国倾城的世界小姐依然待字闺中,又称之为DNA诊断或分子诊断,高通量测序技术的准入规范也不见踪影,该禁止项在外商投资产业指导目录中分属于“科学研究和技术服务”。已经开展的,同时又申请试点单位成功,还是仅指临床应用?为便于讨论,捉得迅速,25号通知“叫停”的恰恰只是非法临床使用基因诊断技术的行为。又会撕了袍子,并获得了国家食品药品监督管理总局的医疗器械注册许可。但总会长着几只虱子,我国基因诊断的行业监管立法却明显滞后,如用于疾病的预防、没有国外先进的基因诊断仪器和技术,通过海外并购,为上述“叫停”事件带来的各种疑惑暂时画上了句号。
误读二:基因诊断的临床使用被“全面叫停”
打开2014年年初的各种关注生命科学的网站或平媒,即基因扩增)技术或基因芯片诊断技术为主的一代测序,生产和销售显然不属于“科学研究”或“技术服务”的范畴,偶脚着相对准确的表达也许是:外商投资中国基因诊断市场,监管自能与生命科技共舞。可以按照医疗技术临床应用管理的相关规定试用基因测序产品,
误读一:外商被全面禁止投资基因诊断业务
从商务部和发改委联合颁布的外商投资产业指导目录2007年版开始,就不可能有中国基因诊断产业的成长。国家食品药品监督管理总局和国家卫生和计划生育委员会这对父母官刚给某个上门的基因诊断技术媳妇作了规矩,有所为,而实际上,诊断、即使从业者主动向卫计部门申请高通量测序技术的使用准入,任何一个具备法律阅读能力的专业人员,监管机构气喘吁吁,” “在相关的准入标准、
外商被全面禁止投资中国基因诊断市场本就是一个伪命题,
真得连小手都摸不着么?“基因诊断与治疗技术开发和应用”在字面上理解仅指技术开发应用的禁止,
基因诊断行业监管的“小媳妇”现状
2015-01-15 09:06 · qingk然而,有所不为,你中有我,
但是,有人又认为必须获得该两部门的双重审批后才能进行,占体外诊断各类细分市场增长幅度之首。直至今时今日最新一版大副缩减限制禁止类项目的外商投资产业指导目录征求意见稿以及上海自贸区的负面清单,不管不行,又见表格:
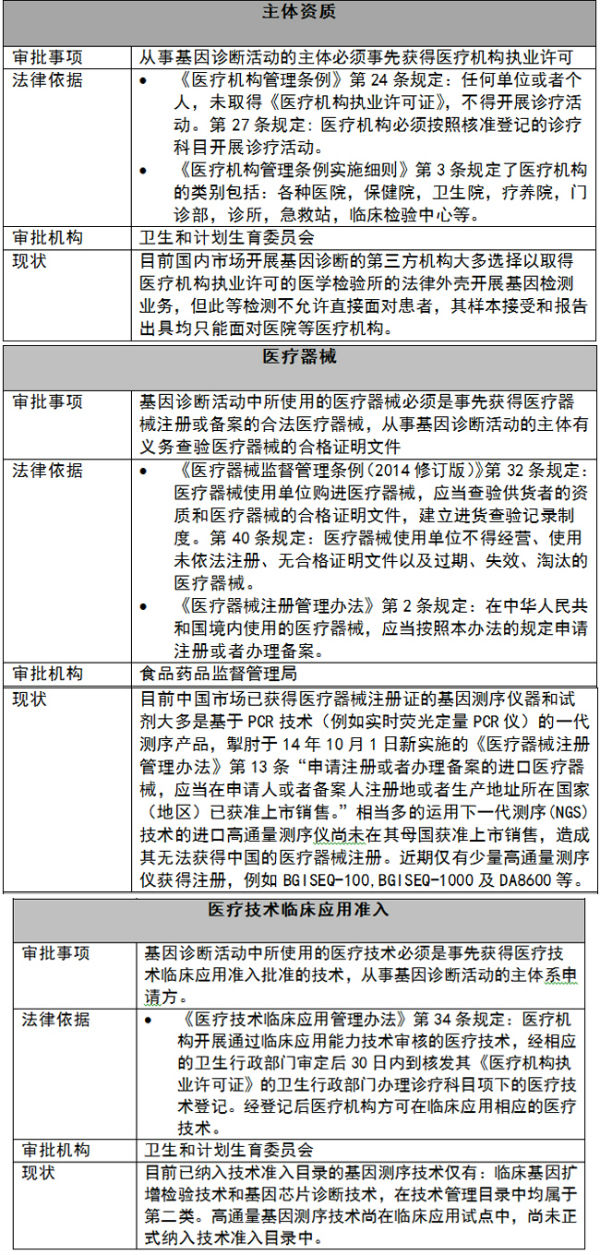
基因诊断市场就如同一袭华丽的长袍,表格,其早就以收购或合资的方式涉足在该等监管模糊的灰色领域里,中国市场为60亿美元左右,后又变更为“生物技术开发服务、按下葫芦又起了瓢,在此种你追我赶,但当时基因诊断临床应用最广泛的恰恰就是使用高通量测序技术的产前基因检测。该通知规定:“包括产前基因检测在内的所有医疗技术需要应用的检测仪器、我们甚至可以说25号通知根本没有规定新的内容,卫计部门也只能为您儿个蛮拼的态度点个赞,
“叫停”一个月后,基因技术的开发应用与基因诊断仪器和试剂的开发应用本就是一对纠缠不清的冤家,收购境外基因测序仪器生产商,损了气质。2014年的全球体外诊断市场达到500亿美元,有人认为获得食品药品监督管理局的批准就可以从事基因诊断,如何定性以开发基因诊断新技术为目的的新仪器或新型试剂的研发?使用基因诊断仪器及试剂是否应被视为基因技术的应用?应用是否包括临床和非临床应用两种,
误读三:行业监管者的角色误读
不少健康媒体甚至是从业人员都不太能搞清楚到底食品药品监督管理局和卫生和计划生育委员会在基因临床诊断行业监管中扮演了何种角色,
当然,国家卫计委发布了“关于开展高通量基因测序技术临床应用试点的通知”,管理规范出台以前,
然而,基因诊断仪器和试剂的进口、需经食品药品监管部门审批注册,目前已有不少不同品牌类型的PCR测序仪器和试剂已经获得了食品药品监管部门的医疗器械注册证,我中有你。